专利战“疫”——冠状病毒疫苗及核酸检测专利技术综述
2019年,新型冠状病毒肺炎(COVID-19)疫情爆发,严重危害公共健康。疫情发生后,为控制病毒传播、保障人民健康与生命安全,医疗界、政府各部门及广大科研工作者正全力以赴开展病毒相关的研究和防控工作。接种疫苗是预防病毒感染的有效手段。随着新型冠状病毒全基因组序列的公布,全世界多个实验室和团队积极开展新型冠状病毒疫苗的研究。浙江大学李兰娟院士的团队目前已成功分离出8株病毒,其中有几株具有应用于疫苗开发的潜质。与此同时,开展相关检测方法和试剂的研发,提供对新型冠状肺炎的早期诊断结果,也是疾病预防、阻断传播、保护人类自身的重要措施之一。本文将从专利的角度对可感染人的冠状病毒疫苗以及冠状病毒核酸检测两方面进行分析,以期为新型冠状病毒疫苗及核酸检测产品的研发提供参考。
第
一
部
分
可感染人的
冠状病毒疫苗专利技术分析
一
全球专利申请概况
(一)专利申请趋势
2003年SARS疫情的爆发,引发了该领域疫苗专利申请量的激增,随着疫情的有效控制,该领域的专利数量逐渐减低,其后,随着2013-2015年中东呼吸综合征(MERS)在不同地区的流行,该领域的专利申请出现了小幅增加。
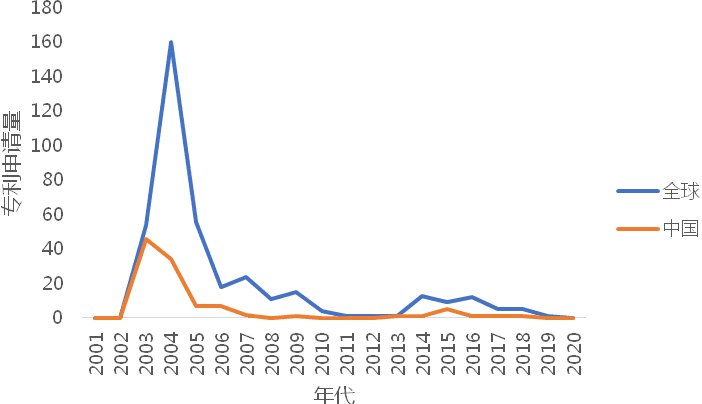
图1-1 全球以及中国可感染人的冠状病毒疫苗专利申请趋势
统计发现,中国在可感染人的冠状病毒疫苗领域的专利申请量位居首位,美国、欧洲、日本、加拿大分列其后。可见,我国在冠状病毒疫苗的研发方面拥有着丰富的经验和技术优势。
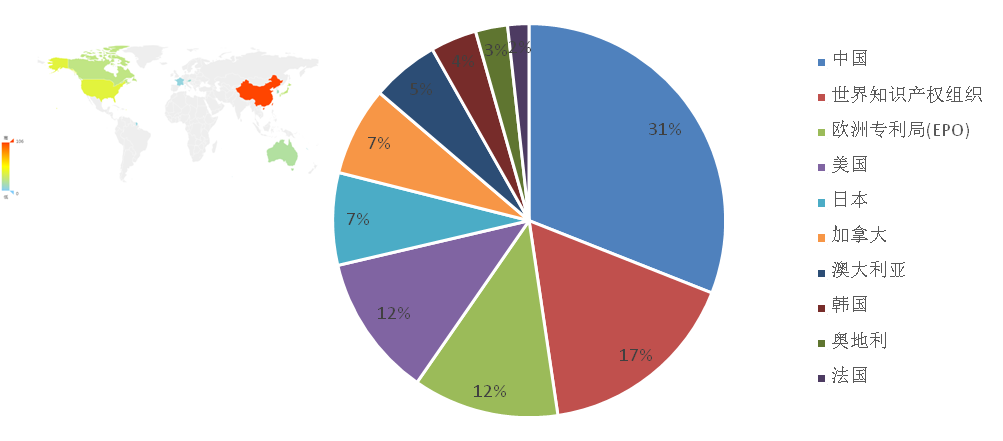
图1-2 可感染人的冠状病毒疫苗专利技术来源国家和地区分布
(二)主要研发机构
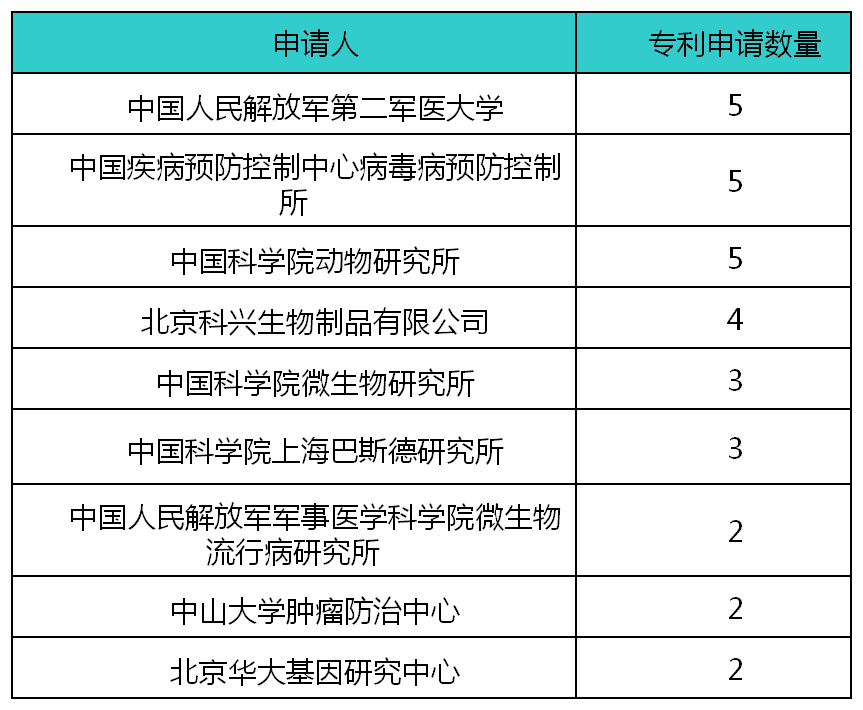
从冠状病毒疫苗专利主要申请人列表中可以看出,国内外对于可感染人的冠状病毒疫苗的研究主要以科研单位和高校为主,由于冠状病毒在传播人方面具有较高的传染性和不良预后,对公共健康具有较大危害,因此以政府为支持的研究机构和院校为该领域的主要研发力量。而企业由于担心该类病毒爆发的疾病会较快退潮,从而导致其为该领域研发投入的资金和人力成本无法收回,因此较少进行布局。
表1-1 全球可感染人的冠状病毒疫苗专利主要申请人

表1-2 我国可感染人的冠状病毒疫苗专利主要申请人
二
主要疫苗类型
可感染人的冠状病毒疫苗主要类型有核酸疫苗、重组亚单位疫苗、减毒疫苗、灭活疫苗和病毒颗粒疫苗,其中重组亚单位疫苗和核酸疫苗占比较多。

图1-3 可感染人的冠状病毒疫苗主要类型分布
1、核酸疫苗
核酸疫苗是指将病原体的保护性抗原基因克隆至载体直接导入动物体内用于免疫的一种疫苗形式。其特点是制备简单,安全性好,可同时诱导体液免疫和细胞免疫应答,对于细胞内病毒感染具有更好的免疫效果。S基因(编码棘突蛋白)和N 基因(编码核壳蛋白)是冠状病毒核酸疫苗研制的主要靶标,其可诱导较高水平的中和抗体和细胞免疫应答。WO2005117960A1中公开了基于SARS-CoV棘突蛋白的DNA疫苗是冠状病毒疫苗的主要靶标。提高核酸疫苗免疫原性的另一常用方法是将几个保护性抗原基因共免疫。例如 CN101020055A中公开了针对SARS-CoV的疫苗,其包含复制型痘苗病毒作为载体,将痘苗病毒基因组的胸苷激酶(TK)区插入编码SARS-CoV核壳蛋白和突起蛋白的多核苷酸。
2、重组亚单位疫苗
将冠状病毒的 S 、M 、N 和 E 基因经基因工程表达并纯化即可制备成病毒重组亚单位疫苗。这类疫苗制备容易,可大规模生产,而且安全性较好,这类疫苗的申请数量也最高。筛选多种可产生有效免疫的保护性抗原蛋白是成功构建重组亚单位疫苗的关键。该领域代表专利包括WO2007010399A3、KR20100114620A、CN106928326B、CN105169384A等。
3、减毒疫苗
减毒活疫苗是通过一定的方法,减弱或去除野生病毒的毒力而保留病毒在宿主体内增殖能力的一类疫苗形式。减毒活疫苗可模拟野生病毒感染的过程,刺激机体免疫系统产生更强的、特异持久的免疫反应特别是细胞免疫反应。采用基因重组技术获得减毒活疫苗是冠状病毒疫苗研究的重要策略,通过这种方法获得的减毒活疫苗不易发生毒力回复,安全性好。获得这类减毒活疫苗的方法包括:基因组嵌合、基因缺失、点突变等,其代表性专利如下:CN100580080A、CN105349498A、WO2006079290A1、WO2006136448A2。
4、灭活疫苗
全病毒灭活疫苗是技术上最易实现且体液免疫效果较好的一种疫苗形式。在分离出 SARS 冠状病毒后国内外一些实验室均迅速开展了SARS-CoV灭活疫苗的研究。但灭活疫苗本身存在不能诱导细胞免疫、疫原性低和产生免疫力慢等不足。该领域代表专利包括:CN1318580A、CN1616654B等。
5、病毒颗粒疫苗
病毒样颗粒(Virus-like Particles,VLPs)是由一种或几种病毒结构蛋白自我组装的、不含病毒核酸的、不可复制增殖的空心颗粒。其结构和真病毒十分相似,且可重复高密度地展示外源抗原表位,因此可以诱导强大的细胞免疫和高效价的中和抗体反应。因其不含病毒基因组,不可在体内外复制和增殖,因此不会造成机体感染。这些特点使得VLPs作为一种安全、有效的疫苗,越来越受到人们的重视。CN106119213A中公开了将流感病毒M1基因以及MERS-CoV的S基因分别插入到pFastBacDual载体中,转染昆虫细胞后获得了重组杆状病毒M1-S。电镜下该VLPs与天然MERS-CoV形态相似。免疫小鼠后,小鼠血清检测到高水平S蛋白特异性IgG抗体以及中和抗体,表明该嵌合型VLPs具有良好的免疫原性。可作为理想的疫苗用于预防或治疗MERS-CoV感染。其代表专利还包括:CN1820020B、US2017095550A1、WO2006024543A1、WO2005063801A2。
第
二
部
分
冠状病毒核酸检测技术专利分析
一
全球专利申请概况
(一)专利申请趋势
2003年4月20日中国政府公开宣布中国大陆部分省市发生“非典型肺炎”,引起“非典型肺炎”的冠状病毒--SARS的检测需求出现,上海科华生物工程股份有限公司提交了第一件SARS病毒核酸检测专利申请CN100350055C。之后,该领域专利申请量的持续增加,并在2004年达到顶峰。随着疫情的有效控制,该领域的专利数量逐渐减低。2013-2015年中东呼吸综合征(MERS)在各地区流行,该领域专利申请量持续增加并于2018年再次达到顶峰。图2-1还显示,2013-2019年该领域专利申请主要集中在中国,全球范围内则在2004年之后零星出现。
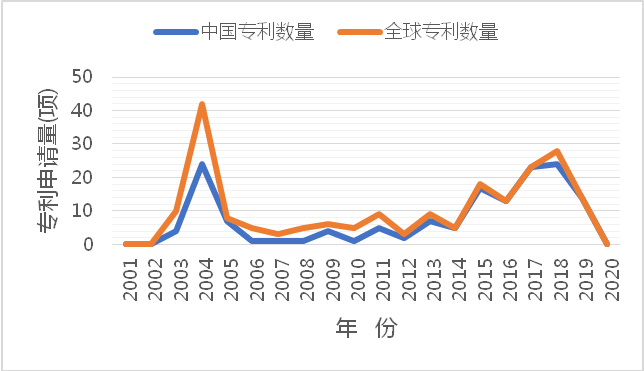
图2-1 全球以及中国冠状病毒核酸检测专利申请趋势
从冠状病毒核酸检测专利技术来源国家和地区分布来看(图2-2),中国为该领域专利技术主要来源国家,美国和韩国紧随其后,显示出该技术对这些国家具有较强的市场吸引力。
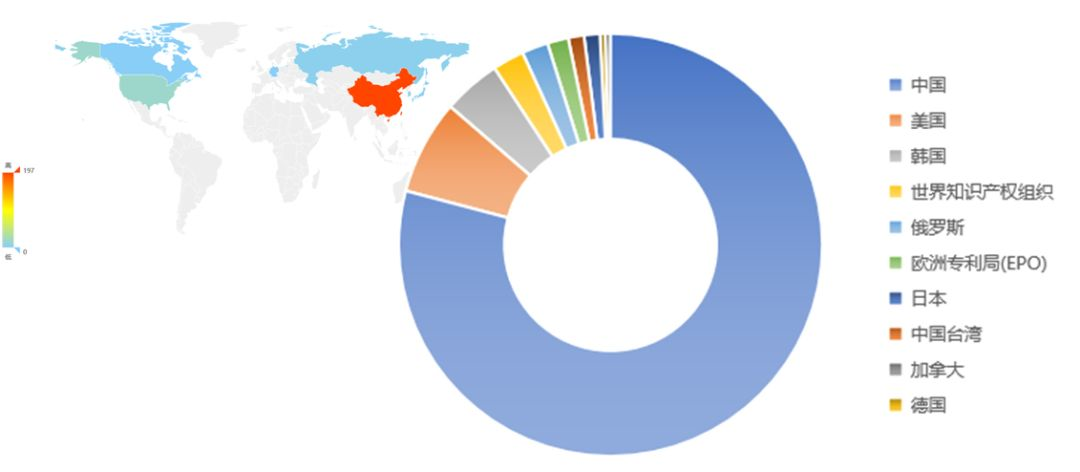
图2-2 冠状病毒核酸检测专利技术来源国家和地区分布
(二)重要申请人综合情况分析
表2-1显示了全球冠状病毒核酸检测技术专利主要申请人,排名前十的申请人中,国外申请人仅占1席,再次表明该领域研发以中国为主,全球重要申请人意味着其同样也是中国重要申请人。可以看到,河南农业大学位列中国申请人首位,湖北出入境检验检疫局检验检疫技术中心及中国检验检疫科学研究院分列二、三位。
与此同时,结合图2-3可以发现,全球(或中国)重要申请人中,大专院校、企业和科研单位专利申请量相当,共占据约90%的份额。分析其原因,一方面,冠状病毒引起的疫情与公共健康密切相关, 因此以政府为支持的研究机构和院校成为该领域的主要的研发力量;另一方面,与疫苗、药物等产品不同,核酸检测试剂或试剂盒的研发周期相对较短、技术难度相对较低、研发投入相对较少,但投入市场后资金回流相对较快,因而吸引了部分企业的关注。
表2-1全球冠状病毒核酸检测专利技术主要申请人
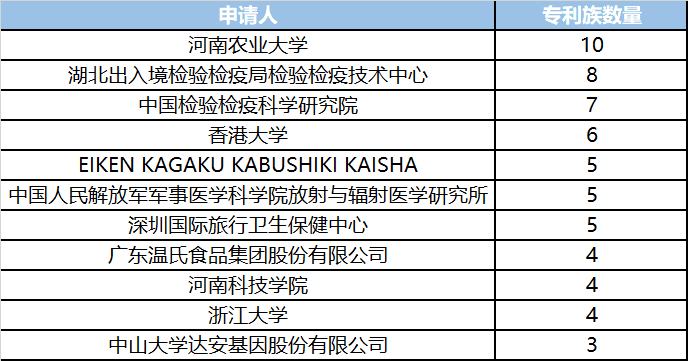
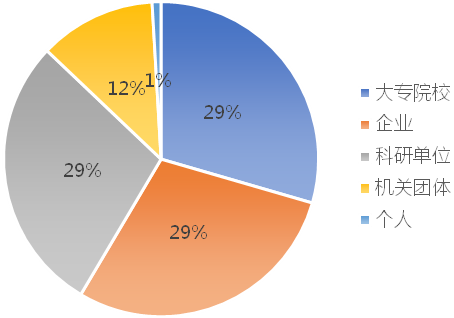
图2-3 冠状病毒核酸检测专利技术申请人类型分析
二
冠状病毒核酸检测技术分析
(一)冠状病毒核酸检测专利技术
依据《新型冠状病毒肺炎诊疗方案(试行第六版)》确诊病例要求,临床诊断病例或疑似病例,具备以下病原学证据之一:1.实时荧光 RT-PCR 检测新型冠状病毒核酸阳性;2.病毒基因测序,与已知的新型冠状病毒高度同源。目前,新型冠状病毒的临床检测以前者为主。然而,前期由于检测能力不足,出现“假阴性”和疑似患者无法确诊的情况,这表明在新型冠状病毒核酸检测试剂方面,尚有改进的空间。
从图2-4可以看到,冠状病毒核酸检测方法大体分为普通PCR、RT-PCR、荧光PCR、RPA/RAA、LAMP、基因芯片以及纳米PCR等其他技术。
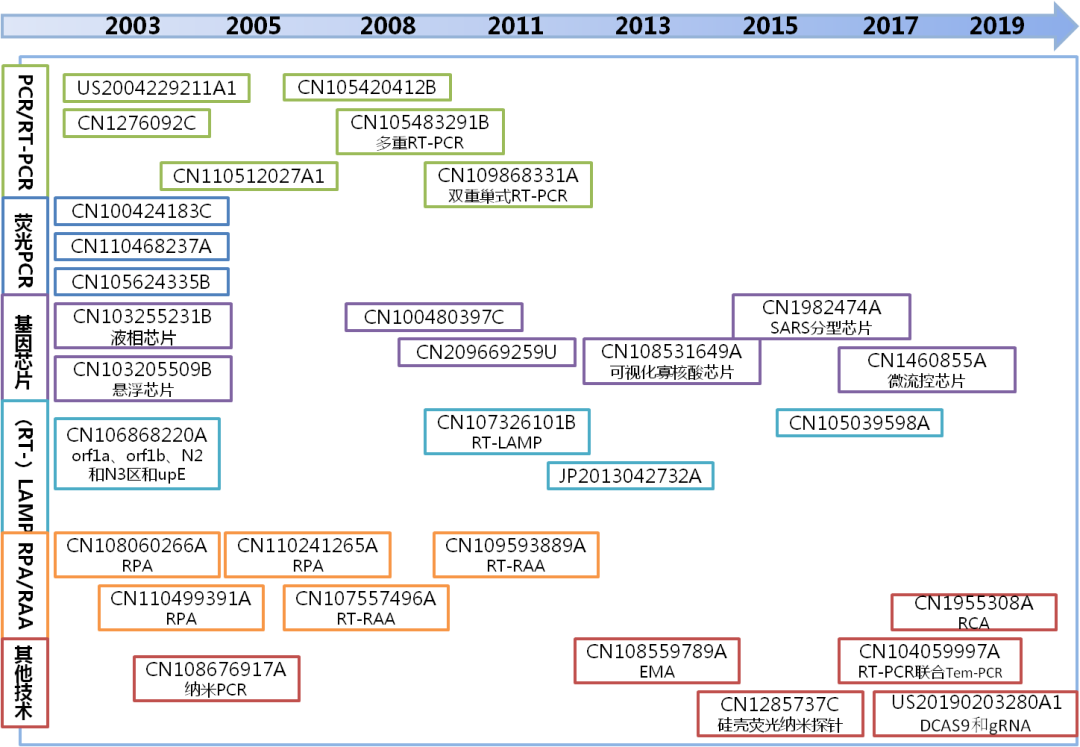
图2-4 冠状病毒核酸检测专利技术
1. RT-PCR
RT-PCR,逆转录PCR或者称反转录PCR,是聚合酶链式反应(PCR)的一种广泛应用的变形。在RT-PCR中,一条RNA链被逆转录成为互补DNA,再以此为模板通过PCR进行DNA扩增。CN1276092C公开了一种反转录PCR方法检测SARS冠状病毒的试剂盒,通过对现有11条SARS病毒的基因组序列分析,选择SARS-COV的基因序列具有高特异性,非同源性的开发阅读框1b(开放阅读框1b)部分进行设计引物,检测限度可达0.01拷贝/100微升。CN104846125B、CN110468237A、CN105624335B分别公开了用于检测MERS的荧光RT‑PCR的试剂盒,其中CN110468237A和CN105624335B是以中东呼吸综合征冠状病毒UPE和N基因为靶基因的多重荧光RT-PCR,并且CN105624335B中公开的试剂盒对18例标本的检测结果与病毒培养鉴定结果完全吻合,表明其具有较高的特异性,且其灵敏度达到100copies/ml。采用RT-PCR方法进行检测的还有CN103484565B、US2004229211A1。随着科研工作者的不断努力,荧光RT-PCR逐渐成为冠状病毒临床核酸检测的主要手段,多靶点、多重RT-PCR将提高病毒检测特异性,提高临床诊断准确性。
2. 基因芯片
基因芯片是指将大量探针分子固定于支持物上后与标记的样品分子进行杂交,通过检测每个探针分子的杂交信号强度进而获取样品分子的数量和序列信息。CN1982474A公开了用于SARS冠状病毒检测与分型的基因芯片,含有从一种或多种株型的SARS冠状病毒的s基因序列中选取的含有s 基因突变位点的DNA片段以及选自SARS冠状病毒s基因保守序列的DNA 片段,填补了芯片对 SARS分型的空白。博奥生物有限公司与清华大学(CN100480397C)联合开发了用于检测SARS病毒的生物芯片。此外,CN103255231B公开了一种核酸平行检测液相芯片,主要由对应呼吸道感染相关病原体的微球、探针、特异性引物、生物素化的通用引物及链霉亲和素-藻红蛋白组成,可同时检测包括人冠状病毒在内的11种呼吸道病原,具有高通量、高稳定性、高敏感性的特点。类似地,CN103205509B也开发了基于微球的可检测SARS-Cov、Cov-NL63在内的13种呼吸道病毒的高通量新型悬浮芯片。CN107090519A、CN109988869A、KR100562355B1也均涉及基因芯片或微流控芯片检测技术。
3. LAMP
LAMP,即环介导等温扩增技术,已成功地应用于SARS、禽流感、HIV等疾病的检测中。该方法主要是利用4种不同的特异性引物识别靶基因的特定区域,在等温条件进行扩增反应。与常规基因检测手段(如PCR等)相比,LAMP反应在恒温水浴箱便可完成,仪器设备要求低,较传统PCR和培养法操作简单许多,不需要专业人员也可准确完成,适合基层医疗机构的应用。并且,LAMP还可以大大缩短操作时间,减少了样品污染机会,适合应用于冠状病毒的快速诊断。CN106868220A公开了检测MERS-CoV的LAMP试剂盒,其以orf1a、orf1b、N2和N3区和upE片段为靶序列,可快速、灵敏检测MERS-CoV。类似的专利还有JP2013042732A、CN107326101B、CN105039598A。RT-LAMP可将逆转录与LAMP结合起来,例如CN107326101B。但LAMP引物设计复杂,且对SNP识别度不够。另外,若待检测区域的GC含量过低、过高或者二级结构复杂,则扩增效果较差。
4. RPA/RAA
RPA即重组酶聚合酶扩增,RAA即重组酶介导的等温扩增,为核酸等温扩增的创新技术,涉及重组酶、单链结合蛋白和DNA聚合酶三种酶,在等温条件37℃下快速扩增。二者反应原理类似,区别在于RAA的重组酶为从细菌或真菌中获得的重组酶如recA,RPA则利用的是T4重组酶。RPA代表性专利为CN108060266A、CN110499391A、CN110241265A;RT-RAA代表性专利为CN107557496A、CN110283938A。该方法优点在于,反应不需昂贵的仪器,反应产物可直接用于测序或连接到载体,引物设计简单。但是,体系中引物二聚体会造成较高的荧光或胶体金假阳性,且由于体系蛋白质含量较高,扩增条带需先进行纯化或酚抽提才能进行琼脂糖凝胶电泳。
5.其他技术
随着病毒核酸检测技术的不断发展,涌现出不少新技术和改进的检测方法。例如CN108676917A公开了一种鉴别CCoVⅠ和CCoVⅡ的双重纳米RT‑PCR检测方法,通过在反应缓冲液中添加粒径为1nm~100nm的纳米金属颗粒,加快温度升高和下降的速度,减少在非目标温度的停留时间,从而减少了反应非特异性扩增,比普通RT-PCR最低核酸检测量高出100倍。CN108559789A公开了采用EMA(即多酶介导的核酸扩增技术)方法检测猫冠状病毒,逆转录与DNA复制一步完成,耗时少,灵敏度高。CN104059997A基于多重荧光实时PCR和Tem-PCR技术进行RT-PCR,大大提高了扩增效率,降低了引物二聚体的产生,提高了检测灵敏度。新技术的涌现和技术的改进丰富了病原体的检测手段,提高检测特异性和灵敏度的同时,简化了反应过程,为病原体检测提供了更加强有力的手段。
(二)冠状病毒检测出现“假阴性”的因素
冠状病毒临床检测过程大体包括样本采集、样本的保存与运输、病毒灭活处理、病毒裂解与核酸提取、核酸检测五个环节,每个环节都会对冠状病毒检测结果产生影响。阴性检测结果意味着可能未被感染,或意味着感染尚未发展到足以被检测的程度。临床上“假阴性”会造成疾病“漏诊”。以样本采集为例,根据《新型冠状病毒实验室检测技术指南》,对检测标本采集,标本的种类里有上呼吸道标本(咽拭子、鼻拭子、鼻咽抽取物),下呼吸道标本(深咳痰液、呼吸道抽取物、支气管灌洗液、肺泡灌洗液、肺组织活检标本),血液标本,血清标本,后来又增加了粪便、肛拭子。与上呼吸道样本相比,下呼吸道标本中病毒更多,因而更易检测。但是,下呼吸道样本取样较上呼吸道取样困难,因而临床取样常以鼻咽拭子为主。当患者体内病毒含量少时,其上呼吸道标本中病毒含量更少,更不易检测,因而有时会出现“假阴性”。

图2-5 冠状病毒核酸检测流程
此外,由于疫情突发,核酸检测试剂盒的研发和审批加快,使得一些特异性和灵敏度不够高的试剂盒流入市场,也是造成临床检测结果出现“假阴性”的重要原因。另外,高精度的检测设备和仪器成本较高,而采用精度不够的普通检测设备和仪器,即使样本处理得当也有可能检测不到病毒核酸,从而出现“假阴性”。

图2-6 冠状病毒核酸检测结果“假阴性”的影响因素
结语
新型冠状病毒肺炎疫情的出现是对我国公共卫生管理部门应急反应能力的一次巨大挑战,但同时也给医学、生物学等领域的科研工作者带来许多新的启示。一方面,新型冠状病毒的毒株已经成功分离出来,其全基因组序列也被披露,这些都为疫苗的研发提供了基础,国内外数个研究团队正多路径加紧对新型冠状病毒感染肺炎疫苗的研发。另一方面,为积极应对新型冠状病毒感染肺炎疫情,国家药品监督管理局启动《医疗器械应急审批程序》,目前,已批准 7 家企业的新型冠状病毒 COVID-19核酸检测试剂盒上市。相信在不久的将来,科学家们定能研制出行之有效的新型冠状病毒疫苗,以及更特异、更灵敏的COVID-19核酸检测产品,为抗击新型冠状病毒肺炎提供决胜利器!
THE END
注:数据库来源incopat,新型冠状病毒感染肺炎防疫专利信息共享平台http://fy.patentstar.com.cn/
参考文献:
[1]陈伟.4例新型冠状病毒感染病例咽拭子与痰标本病毒核酸检测的比较 [J].中国人兽共患病学报网络首发文,2020:1-7页.
[2]冯艳铭; 李振勇; 刘宁.实时荧光RT-PCR在SARS病毒定量检测中的应用[J]. 临床检验杂志,2009(01): 104-107.
[3]詹菁,新型冠状病毒 2019-CoV的一些初步认识[J],环境化学,39(2):283-291.
[4]代娟,陆家海.SARS疫苗研究进展[J].热带医学杂志,2008(08):880-883.
[5]董关木,王军志.SARS疫苗的研究进展[J].中国生物制品学杂志,2004(01):64-66.
[6]姜涛,秦鄂德.SARS疫苗研究进展[J].国外医学.病毒学分册,2004(06):171-175
[7]《新型冠状病毒实验室检测技术指南》.
[8]假阴性,新冠肺炎核酸检测逃不开的问题,果壳微信公众号.
[9]新冠病毒核酸检测漏检,问题出在哪儿,NEJM医学前沿.